○○の新薬が開発中という情報は入ってくるけど、実際にいつ承認されるのか、どの時点で情報が手に入るのかは難しいですよね。
そこで、病院薬剤師やくごろうが新薬の承認情報を誰よりも早く、簡単に得ることができる具体的な方法を紹介します。製薬業界投資家のみなさんも必見です。
新薬開発の流れをざっくり解説
まずは、新薬が開発されるまでの流れをおさらいします。
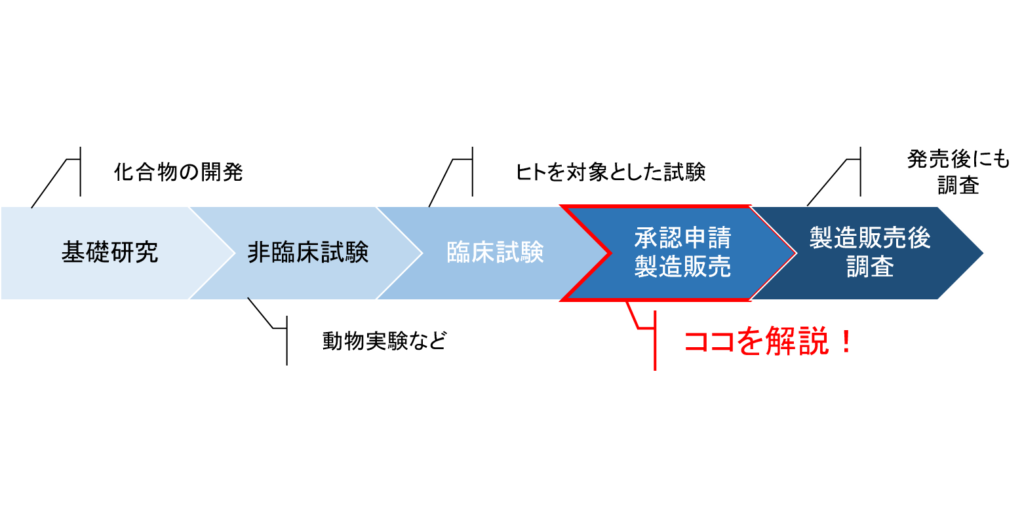
上記が医薬品開発のざっくりとした流れです。
薬学部は教科書でしっかり習うのですが、特に承認申請の流れはイメージがつかなかった記憶があります。
今回は「新薬の承認情報をいち早く得る」ことを目的としているため、赤枠の部分に特に注目していきます。
承認申請~承認までの流れをざっくり解説
医薬品医療機器総合機構(以下、PMDA)がまとめてくれています。
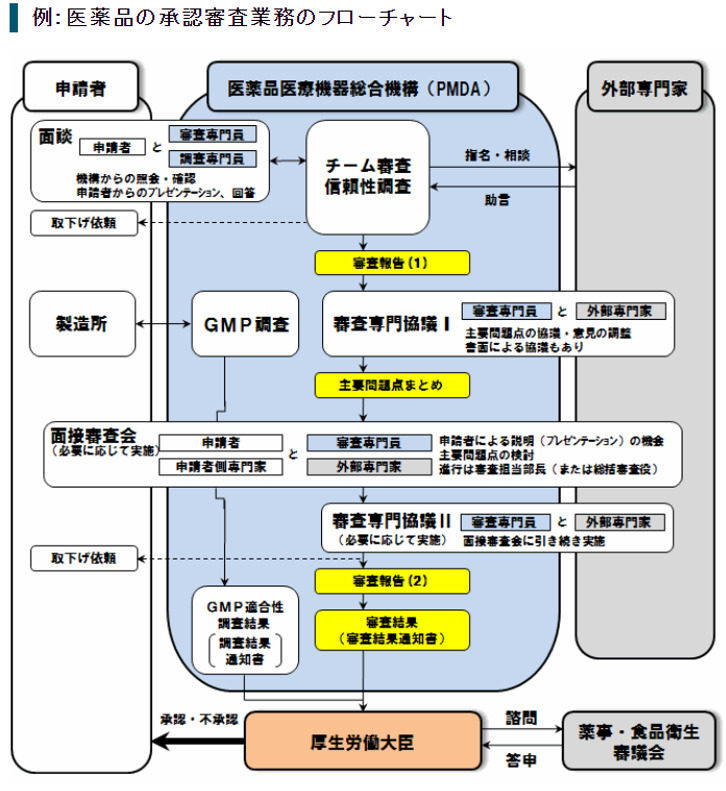
少し複雑なので、本当にざっくりまとめました。
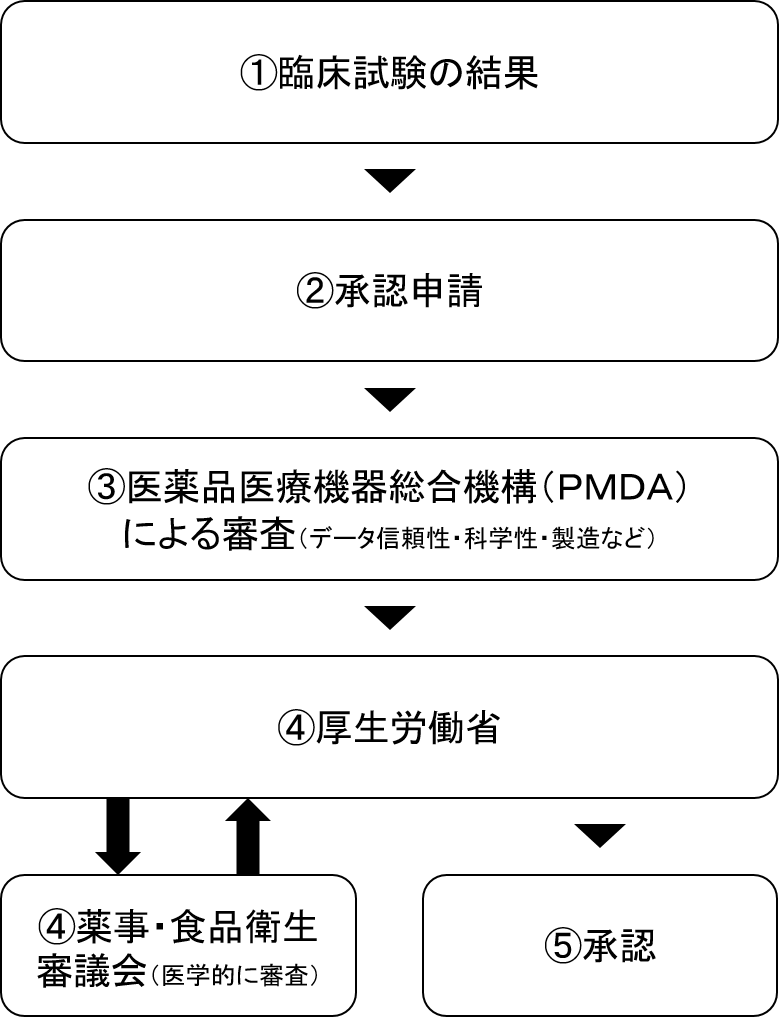
上記が臨床試験後、承認申請~承認されるまでの簡単なイメージ図です。
(実際はもっと複雑で色々な工程があります)
①臨床試験の結果
新薬の申請は、臨床試験の結果を根拠として提出します。そのため、臨床試験の結果の解析が終了している必要があります。
新薬の場合は、結果が論文になるのはもう少し先です。
②承認申請
製薬企業がこれまでにまとめた資料を申請する段階です。
一つ前のステップである臨床試験には数年を要することが多く、論文にもなっていないことが多いため、注目している新薬がここで進捗があったことに気づくこともあります。
③医薬品医療機器総合機構(PMDA)による審査
PMDAが提出された資料を基に審査を行います。
ここでの審査は、ごく簡単にまとめると、
- データの信頼性の審査
- 効果、副作用などについて科学的に審査
- 製造、品質の審査
などがあります。
④厚生労働省→薬事・食品衛生審議会へお伺い
PMDAが審査した内容をもとに、厚生労働省が「薬事食品衛生審議会」にお伺いをたてます。
薬事食品衛生審議会は承認の了承をするかしないか判断し、それをもとに厚生労働省が承認を判断します。
⑤承認
晴れて承認となりますが、発売の前に中央社会保険医療協議会などと共に薬価を決めます。
入手可能な情報
インサイダーではない私たち一般人が得られる情報は、下記のものがあります。
- 臨床試験の結果
(製薬企業のプレリリース、論文(もう少し後になってから) - 承認申請
(製薬企業のプレリリース) - 薬事食品衛生審議会による承認の了承可否
(厚生労働省web-site、ニュース記事、製薬企業のプレリリース) - 薬事食品衛生審議会による承認の了承可否
(ニュース記事) - 厚生労働省による承認
(ニュース記事、製薬企業のプレリリース) - 発売
(MRさんが教えてくれる)
実際の例;エドルミズ(アナモレリン)
エドルミズ(アナモレリン)の例
それでは実際承認になった新薬;エドルミズを例にみてみましょう。
①臨床試験の結果;2014年9月29日
スイス・ヘルシングループが Anamorelin/ONO-7643 について非小細胞肺がんに伴う食欲不振/悪液質を対象とした第III相臨床試験(ROMANA 1 試験および ROMANA 2 試験)の結果を発表(小野薬品プレスリリース)(国内は第Ⅱ相臨床試験進行中)
②承認申請:2018年11月27日
グレリン様作用薬、アナモレリン塩酸塩(ONO-7643)がん悪液質に係る効能・効果で国内製造販売承認申請(小野薬品プレスリリース)
③薬事食品衛生審議会による承認の了承可否
2019年8月30日承認了承されず。
薬食審・第一部会 初の経口腎性貧血薬など7製品の承認了承 がん悪液質用薬は継続審議(ミクスオンライン)
2021年1月21日承認了承
薬食審・第一部会 国内初のがん悪液質用薬エドルミズの承認了承 2度目の審議で(ミクスオンライン)
薬事・食品衛生審議会(薬事・食品衛生審議会医薬品第一部会)
④厚生労働省による承認;2021年1月21日
グレリン様作用薬、エドルミズ®錠50mg がん悪液質の効能又は効果で国内製造販売承認を取得(小野薬品プレスリリース)
※⑤は省略
承認されなかったときは、企業のプレスリリースには載りませんでしたね。
日本の審査制度の特別措置
新薬の審査制度には、様々な特別措置があります。
この特別措置の指定有無をみると、その新薬がどんな期待を背負っているかがわかります。
優先審査
新薬の承認審査において、一定の基準を満たす医薬品の審査を優先的に行う制度。
2019年に承認された新有効成分含有医薬品のうち、全承認品目のうち33%(複数区分に該当する品目含む)
迅速審査
迅速に審査する必要が高いと当局から判断されたもの。
申請者からの申請に基づかない 2019年に承認された新有効成分含有医薬品のうち3%(多くは新有効成分含有医薬品ではなく公知申請品目)
希少疾病用医薬品
対象患者数が5万人未満であり、医療上特にその必要性が高いもの。
2019年に承認された新有効成分含有医薬品のうち、全承認品目のうち31%
先駆け審査指定制度
下記の4つの要件を全て満たすもの
- 治療薬の画期性
- 対象疾患の重篤性
- 対象疾患に係る極めて高い有効性
- 世界に先駆けて日本で早期開発、申請する意思
2015年から25品目指定→11品目承認済み、3品目指定取り消し(2021年3月13日時点)
ゾフルーザ、アキャルックス、エンハーツ、ロズリートレクなど
最も注目すべき情報
病院薬剤師やくごろうが新薬の承認情報を誰よりも早く、簡単に得ることができる具体的な方法は、ズバリ「薬事食品衛生審議会による承認の了承可否」の速報ニュースをみることでしょう!
その理由は
- 製薬企業各社ごとにプレリリースを見るのは大変
- 承認申請だけでは、承認まで時間がかかり、エドルミズのように承認の了承が延期となる場合がある
- 「薬事食品衛生審議会による承認の了承」が事実上の承認となる
- 速報ニュースでまとめて見れる
が挙げられます。
投資家の方々は「薬事食品衛生審議会による承認の了承」と合わせて、先駆け審査指定制度にも注目するといいかもしれませんね。
やくごろうが実際に利用しているサイト
最後に、やくごろうが実際に利用しているサイトをご紹介します。
厚生労働省;薬事・食品衛生審議会
https://www.mhlw.go.jp/stf/shingi/indexshingi.html
ミクスオンライン(簡単に無料で見れるニュース)
https://www.mixonline.jp/
日刊薬事(薬事・食品衛生審議会の議題は無料)
https://nk.jiho.jp/
病院薬剤師が年収を上げるための「資産運用」の力
病院薬剤師が年収を上げる3つの力のうち、「資産運用」の力はとても重要です。
「資産運用」の力について、現役病院薬剤師がまとめています。