毎年多くの新薬が開発されますが、調べてみると超希少疾患や類似薬がすでにたくさんある薬効であったり、その新薬の「世の中での注目度」ってわかりにくいですよね。
よくニュースで、“「新薬の○○」は、ある国で「××医薬品」に指定されました”というニュースを目にしますが、なんとなくすごいんだなと思うだけで、どのくらい凄いかイメージつかないことがあります。
そこで、病院薬剤師のやくごろうが「世界が注目する新薬を調べる方法」として、各国の新薬承認制度の特別措置について解説していきます。
それでは見ていきましょう。
各国の承認制度特別措置
日本、アメリカ、ヨーロッパの新薬承認制度の特別措置については、医薬産業政策研究所がまとめています。

各国によって制度は様々
同じ「新薬の承認制度」とはいえ、各国はそれぞれの特別措置を設けることで、迅速な承認や安全性の確保に努めています。
では、特に世界で注目される新薬はどうやって探すか?
それは、各国がその新薬にどういう期待を込めているかが、承認申請制度の“特別措置”の指定という形で分かります。
しかし、特別措置も数が多くてわかりにくいですね。
やくごろうが考える、特に注目される特別措置について解説します。
特に注目される特別措置(世界が注目する新薬)
数多く存在する特別措置のうち、世界がもっとも注目する特別措置について解説します。
日本:先駆け審査指定制度
患者に世界で最先端の医薬品を最も早く提供することを目指し、画期的な医薬品等について迅速な実用化を図ることを目的とする。
- 治療薬の画期性
- 対象疾患の重篤性
- 対象疾患に係る極めて高い有効性
- 世界に先駆けて日本で早期開発、申請する意思
の4つの要件を満たすもの。
医薬品、医療機器、体外診断用医薬品、再生医療等製品に分かれる。
ゾフルーザ、エンハーツ、アキャルックス、アデュカヌマブ(取り消し)など
再生医療等製品では
ゾルンゲスマ、サンバイオの薬など
“日本で”がポイントです
アメリカ(FDA):Breakthrough Therapy
重篤もしくは致命的な疾患の治療のため,予備的な臨床結果が少なくとも1つの臨床的に重要なエンドポイントにおいて,既存の治療を超える改善が示された場合,その薬の開発や審査を促進することを目的としている
オプジーボ、キイトルーダ、ハーボニー、ベネトクラクス、キムリアなど
ヨーロッパ(EMA):PRIME
早期臨床データでアンメットメディカルニーズのある患者にベネフィットがある可能性を示し、既存治療薬より有用性が上回っていたり、治療法のない分野で便益をもたらす薬剤にはEU内で優先審査対象とする制度。
キムリア、ゾルゲンスマ、アデュカヌマブ(取り消し)など
希少疾患、アンメットメディカルニーズに特化していますね
実際の例
ゾフルーザ(バロキサビル マルボキシル)
- 2018年11月1日外傷性脳損傷の治験で主要評価項目達成
- 2017年10月25日製造販売承認申請
- シオノギ製薬プレスリリース:新規インフルエンザ治療薬候補S-033188の国内製造販売承認申請について-先駆け審査指定制度下での承認申請を実施-
- 2018年2月2日薬事・食品衛生審議会 医薬品第二部会承認の了承
- 2018年2月23日製造販売承認
- シオノギ製薬プレスリリース:抗インフルエンザウイルス薬「ゾフルーザ錠10mg・20mg」の製造販売承認取得について
- 2018年3月14日発売
- シオノギ製薬プレスリリース:抗インフルエンザウイルス薬「ゾフルーザTM錠10mg・20mg」新発売のお知らせ
申請から約半年のスピード承認ですね。
株価をみてみましょう
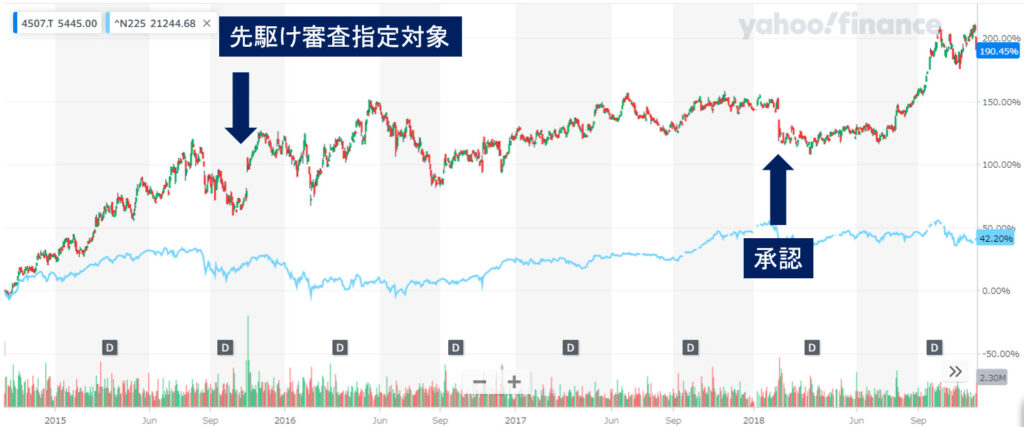
先駆け審査指定対象となった日は株価が急騰していますね。
承認後は一旦調整がありましたが、次のインフルエンザシーズンに向けて上昇しています。
サンバイオの薬(SB623)
- 2018年11月1日外傷性脳損傷の治験で主要評価項目達成
- サンバイオ株式会社IRニュース:SB623外傷性脳損傷を対象にした第2相試験(STEMTRA試験)結果に関するお知らせ‐主要評価項目を達成‐
- 2019年1月29日臨床試験ネガティブな結果
- サンバイオ株式会社IRニュース:再生細胞医薬品「SB623」慢性期脳梗塞を対象にした米国でのフェーズ2b臨床試験の解析結果速報を受けて
- 2019年4月8日厚生労働省先駆け審査指定制度対象品目に指定
- サンバイオ株式会社IRニュース:慢性期外傷性脳損傷を対象にした再生細胞薬SB623が、厚生労働省「先駆け審査指定制度」の対象品目に指定について
- 2020年12月15日承認申請遅延のアナウンス
- サンバイオ株式会社IRニュース:再生細胞医薬品「SB623」慢性期外傷性脳損傷プログラムの国内製造販売承認申請の状況について
※それぞれサンバイオ株式会社IRニュースより
株価をみてみましょう
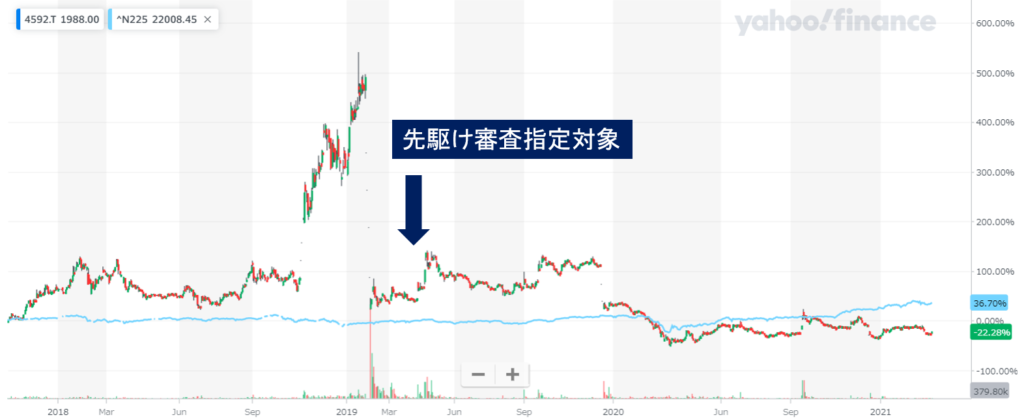
バイオ株の代表、サンバイオは臨床試験のポジティブな結果で急騰し、ネガティブな結果で急落しています。
株価を見るとぞっとします。
先駆け指定になったからと言って、承認されるまではなにがあるかわかりません。
アデュカヌマブ
- 2016年6月7日EMAがPRIME制度対象品目へ指定
- 2017年4月21日厚生労働省が先駆け審査指定品目へ指定
- 2018年7月6日臨床第Ⅱ相試験でポジティブな結果
- 2019年3月21日臨床試験中止を発表(PRIME指定と先駆け審査指定取り消し)
- 2019年10月22日開発再開
- 2020年7月8日FDAへ承認申請
- 2020年10月21日EMAへ承認申請
- 2020年11月7日FDA諮問委員会のネガティブな提言
- 2020年12月10日日本において新薬承認を申請
- 2021年1月29日FDA承認審査期間の延長を発表
それぞれエーザイ株式会社ニュースリリースより
開発もとのバイオジェンの株価をみてみましょう
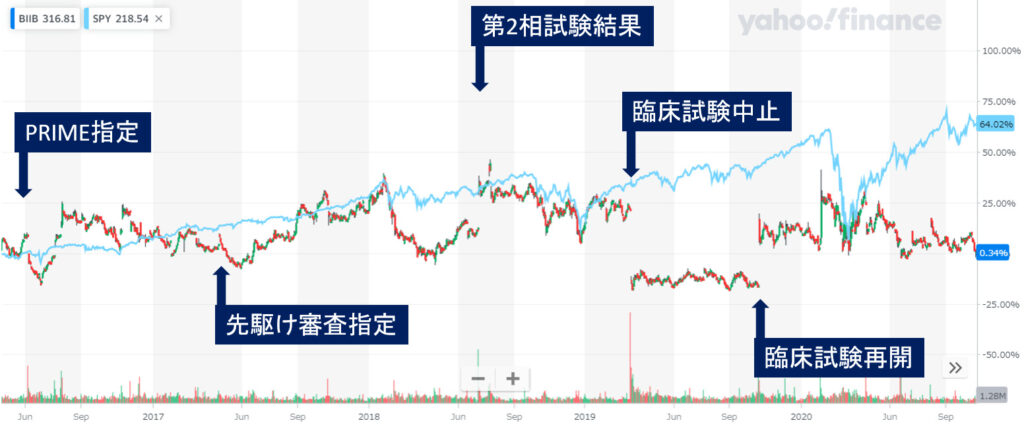
期待されて優先審査されても、承認されるまでなにがあるかわからないですね。
情報を得る方法
日本:先駆け審査指定制度
PMDAサイト
https://www.pmda.go.jp/review-services/drug-reviews/0003.html
アメリカFDA:Breakthrough Therapy
FDAサイト
https://www.fda.gov/drugs/nda-and-bla-approvals/breakthrough-therapy-approvals
ヨーロッパ(EMA):PRIME
EMAサイト
https://www.ema.europa.eu/en/human-regulatory/research-development/prime-priority-medicines
それぞれの製薬企業のプレスリリース
英語で分かりにくいものは、ページごとgoogle翻訳でも十分わかりますよ
まとめ:世界が注目する新薬を調べる方法
まずは承認申請制度の特別措置の種類を知る
海外も含めて、これを知ることで、どのくらい注目されているかわかります!
投資家が注目するポイント
投資家の皆さんは、先駆け審査指定品目やBreakthrough Therapyのような特に注目される特別措置について興味があるかもしれませんね
ただ、新薬は承認されるとは限らない
これは決して忘れてはならないことです。
どんなに期待されていても…
SB623やアデュカヌマブのように、指定を受けたにも関わらず結果が出ないこともあります。
その場合、株価は悲惨なことになります。
一つの新薬に注目することはリスクが高いですね。
サンバイオやバイオジェンのような小規模バイオ株の株価は上下が激しいです。
これがバイオ株が難しいと言われる所以だと思います。
製薬技術や、新薬の特許自体に投資する企業に注目することもよさそう
画期的新薬の承認に投資することは、華はあるものの、一種のチャレンジで本当にタイミングが合わないと大きく資産を減らすことになりかねません。
一つの新薬の承認に賭けるよりは、製薬技術や新薬の特許自体に投資する企業に注目することも一つの方法だと思います。
Halozyme Therapeutics社やRoyalty Pharma社についても薬剤師の視点で調べていますので、こちらも注目してみて下さい。
>>>Halozyme社($HALO)の新技術;抗がん剤の点滴時間を短くする
>>>Royalty Pharma ($RPRX)のロイヤリティを病院薬剤師が徹底検証
病院薬剤師が年収を上げるための「資産運用」の力
病院薬剤師が年収を上げる3つの力のうち、「資産運用」の力はとても重要です。
「資産運用」の力について、現役病院薬剤師がまとめています。