- 初めて英語論文を読むけど、どうしたらいいかわからない。
- 効率いい英語論文の読み方を知りたい。
- 他の薬剤師と差をつけたい。
薬の情報を調べたいときに、日本語でいくら検索しても情報がなくて困ったことはありませんか?
こんな時、英語論文で情報があることも多いです。そして英語論文は先輩から課題として出される方も少なくないと思います。
しかし、英語なんて読んだことないし、大変そうだし、誰かが教えてくれるわけでもないし…と諦めてしまう人は多いです。
私も英語は読めないので極力避けてきました。しかし、少しずつ英語論文にふれていくうちに、「型」があることに気づき、少しずつ分かるようになってきました。
今では、月に数本は読むだけでなく、英語で論文もいくつか執筆することもできました。
英語論文を読めると、他の薬剤師や医師が知らない情報を得られるのでとても重宝されます。
そこで、この記事では先輩には言えない超簡単な英語論文の読み方について現役病院薬剤師のやくごろうが解説します。
この記事を読めば、英語論文をポイントを絞って簡単に読めるようになり、他の薬剤師や医師が知らない情報を得ることができます。
できるだけ楽して英語論文を読みたい薬剤師の方におすすめです!
※英語論文に慣れていない薬剤師向けの内容です。手抜きをする方法を書きましたので、ベテラン先輩薬剤師の方はこのページをそっと閉じてください。
英語論文の簡単な読み方:型・読む順番・キーワードをおさえてgoogle翻訳フル活用
英語論文を読みたいけど、英語はできない。という方がほとんどだと思います。私も英語は読めません。
そこで活躍するのがgoogle翻訳です。最近はかなり精度が高く、無料で便利なツールですので、もちろんフル活用します。
先輩には「自分で訳さないと力にならないぞ」と言われそうで、決して大きな声では言えませんがいつもgoogle翻訳に頼っています。
しかし、google翻訳をフル活用したとしても、英語論文全て読むのは大変です。
英語論文をざっくり読むためには、まずは「型」を知り、「読む順番」を工夫し、「キーワード」を目印にして読むと簡単に読めます。
ここから、英語論文の読み方で重要な
- 型
- 読む順番
- キーワード
について実例を用いて解説していきます。
英語論文の読み方:論文は3つの種類で「型」が異なる
医学分野の英語論文は、大きく3つの種類があり、それぞれで「型」が異なります。
- 原著論文(Original Article, Clinical Trialなど)
- 総説(Review)
- 症例報告(Case report)
原著論文(Original Article, Clinical Trialなど)
いわゆる「論文」としてもっとも多い種類です。
臨床試験などの研究結果が書いてある場合が多いです。
原著論文の型は、
- Abstract(要約)
- Introduction(緒言、背景)
- Methods(方法)
- Results(結果)
- Discussion(考察)
であることがほとんどです。
総説(Review)
今まである原著論文を、その分野の専門家がまとめたものです。
参考書のようなイメージで、疾患をまとめて勉強するときにとても役に立ちます。
例えば、
”Neoadjuvant and adjuvant therapy for Stage III non-small cell lung cancer.”
→” III期の非小細胞肺癌に対する術前補助療法および補助療法”
(Jpn J Clin Oncol. 2017 Dec 1 ; 47(12): 1112-1118.)
こんな感じの参考書のようなタイトルになっています。
まとめ方は専門家によって異なるため、決まった型はあまりありません。
症例報告(Case report)
珍しい症例が報告されるものです。
Case reportの「型」は、
- 症例の概要
- 診断
- 行った治療
- 経過
- 考察(既存の治療との比較)
となります。
ほとんどが珍しい一例のみの報告なので、論文自体のエビデンスレベルはあまり高くないです。
しかし、考察で「既存の治療は○○だが~」と書かれているところはとても勉強になります。
医師が「症例報告レベルですが…」といいうのはこれですね
今回は、英語論文で最も多い種類である、原著論文(Original Article, Clinical Trialなど)の読み方を実際にオプジーボの論文の例で解説していきます。
これから使用する参考文献(無料で読めます)
Nivolumab versus Docetaxel in Advanced Squamous-Cell Non–Small-Cell Lung Cancer.
(N Engl J Med. 2015 Jul 9;373(2):123-35.)
英語論文の読み方:「順番」は最初から全部読まない
英語論文は、最初から全部読んだりしません。
これも先輩に言ったら怒られるかもしれませんが、英語論文を最初から全部読んだらとても時間がかかりますし、途中で挫折してしまいます。
ここでは、いかに手を抜いて読むかを読む順番で工夫します。
英語論文を読む順番①読む前に「質」を掲載ジャーナルで確認
英語論文の読み方について教えられると、必ず「英語論文の質を評価しましょう」と教えられます。
確かに、英語論文といってもピンキリです。とても権威のあるジャーナルから、お金を払えば掲載してくれるようなジャーナルまで本当に数多く存在します。
とはいえ、自分で英語論文の質やデザイン、統計などを評価できるほど経験がないという方がほとんどだと思います。
しかし、あなたが英語論文を評価する前に、掲載しているジャーナルが掲載する価値のある論文かどうか先に評価しているので、これを利用しましょう。
権威のあるジャーナルでは、内容の信憑性や統計の妥当性など、掲載までに専門家による厳しいチェック(査読)がされます。
このため、「ジャーナルの質が高い=英語論文の質も高い」ことがほとんどなので、自分で判断できない時はジャーナルの質を目安にするとよいでしょう。
ジャーナルの質は「Impact Factor(IF)」の高さで判断することができますが、ここではざっくり解説なので割愛します。
権威のあるジャーナルとして信頼できる、以下の4つは必ずおさえておきましょう。
- NEJM(The New England Journal of Medicine)(IF=79.260)
- The Lancet (IF=53.254)
- JAMA(The Journal of the American Medical Association) (IF=47.661)
- BMJ(British Medical Journal) (IF=23.562)
※IFは2017年の数値
これらのジャーナルに載ったら、新薬承認や添付文書改訂になるレベルです。
今回使用する論文は、”N Engl J Med” → NEJMなので、質の高い論文として安心して読めます。
英語論文を読む順番②本文の2か所をgoogle翻訳で内容をざっくり把握
まずは英語論文の内容をざっくり把握することから始めます。
何が書いてあるのか内容をざっくり把握することで、その後の文章が読みやすくなります。
最初に翻訳するのは、本文中の下記の2か所です。
- Introduction(緒言、背景)の最後の一文
- Discussion(考察)一番最後の段落
※本文が有料でないと読めない場合は、Abstractで代用することもあります。
実際にgoogle翻訳を使ってみると、こうなります。
このように、内容がざっくりわかります。
※日本語を読んで、よく意味が通っていないときだけ英文もざっと見直しましょう。
特に、google翻訳は「and」や「or」周辺の翻訳は苦手な印象があります。
英語論文を読む順番③:AbstractでPICO(PECO)を把握する
もう少し内容を理解するために、PICO(PECO)を把握します。
- P:Patient(対象患者)
- I:Intervention(治療介入)、E:Exposure(曝露)
- C:Comparison(比較対象)
- O:Outcome(結果)
ほとんどの研究論文は、上記で要約することが可能です。
基本的にはAbstractに書いてある事が多いです。
実際にAbstractをgoogle翻訳してみます。

この論文のPICOは、下記になります。
- P(対象患者):一次化学療法中または化学療法後に疾患が進行した進行扁平上皮非小細胞肺がん(NSCLC)の患者
- I(治療介入):2週間ごとに体重1キログラムあたり3mgのニボルマブ
- C(比較対象):3週間ごとに体表面積1平方メートルあたり75mgのドセタキセル
- O(結果):
①全生存期間の中央値はニボルマブで9.2か月、ドセタキセルでは6.0か月。
②奏効率はニボルマブで20%、ドセタキセルで9%。
③無増悪生存期間の中央値はニボルマブで3.5か月、ドセタキセルで2.8か月。
④PD-1リガンド(PD-L1)の発現は、予後も予測もされませんでした。
⑤グレード3または4の有害事象は、ドセタキセル群の患者の55%、ニボルマブ群の患者の7%。
ここまでわかれば、おおよその内容は把握できたようなものでしょう。
ここまで読んで満足することも多いです。
英語論文の読み方③:本文ではキーワードを見つける
大まかな内容は把握できましたが、もう少し詳しい情報を知りたいときは本文を読みます。
しかし、ここでも全部読むのは大変なので、Introduction、Methods、Results、Discussionごとにキーワードを目印にして読んでいきます。
Introduction
- (最後の段落で)In this study、present study、this report、など
「この論文では~」と何について書かれている論文かが書かれている
Methods
- eligible⇔ ineligible
(適合する⇔不適合) - inclusion⇔exclusion
(組み入れ⇔除外) - randomized⇔non-randomized
(ランダム化⇔非ランダム化) - brind⇔open-label
(盲検⇔非盲検) - prospective⇔retrospective
(前向き⇔後ろ向き) - superior⇔non-inferior
(優越性⇔非劣勢)
Results
- assigned
(割り当てられた) - primary endpoint(outcome)
(主要評価項目) - secondary endpoint(outcome)
(二次評価項目) - significant
(有意に)
Discussion
- (最初の段落で)In this study、present study~、This report~など
「この論文では~」とResultsの内容が要約されている - Limitation
(研究の限界) - Conlusion
(結論)
それぞれのセクションで見ていきましょう
英語論文のIntroduction(緒言、背景)
Introductionで書かれる内容は、
- なぜこの論文を書いたのか
- 今までに分かっていること
- 分かっていないこと
- どんな論文か
が書かれています。
ざっくり内容を把握するには、「どんな論文か」が重要なので、一番最後の一文を読むようにしましょう。
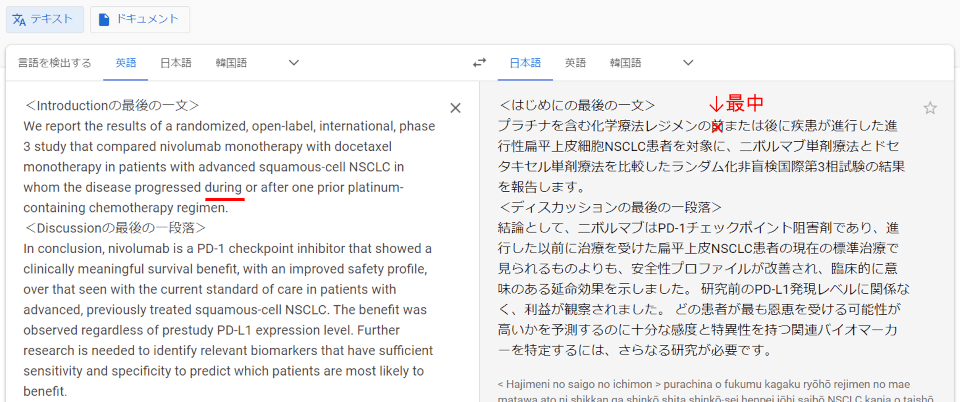
<本文>We report the results of a randomized, openlabel, international, phase 3 study that compared nivolumab monotherapy with docetaxel monotherapy in patients with advanced squamous-cell NSCLC in whom the disease progressed during or after one prior platinum-containing chemotherapy regimen.
“プラチナを含む化学療法レジメンの前または後に疾患が進行した進行性扁平上皮細胞NSCLC患者を対象に、ニボルマブ単剤療法とドセタキセル単剤療法を比較したランダム化非盲検国際第3相試験の結果を報告します。”
※余裕があれば、「今までに分かっていること」を読むと勉強になります。
「NSCLCの二次治療は1999年にドセタキセルが承認されて以降ずっと変わらずなんだ」と勉強になります。
英語論文のMethods(方法)
Methodsはさらに下記に分かれます。
- Patients(対象患者)
- Study design(研究デザイン)
- Endpoint(評価項目)など用語の定義
- Statistical analysis(統計解析)
ここで注目するのは、下記の項目です。
- 組み入れ規準⇔除外基準
- 前向き⇔後ろ向き
- ランダム化⇔非ランダム化
- 盲検⇔非盲検
- 研究の評価項目
- 優越性試験⇔非劣勢試験
これらを把握すると、Abstractではわからなかったもう少し詳しいPICOを知ることができます。
<組み入れ規準>Patients with stage IIIB or IV squamous-cell NSCLC who had disease recurrence after one prior platinum-containing regimen were eligible for participation in the study. Eligible patients were 18 years of age or older, had an Eastern Cooperative Oncology Group (ECOG) performance-status score of 0 or 1 (on a scale from 0 to 5, with higher scores indicating greater disability; a score of 0 indicates no symptoms, and 1 mild symptoms), and had submitted a pretreatment tumor-tissue specimen for biomarker analyses.
“以前のプラチナ含有レジメンの1つ後に疾患が再発したステージIIIBまたはIVの扁平上皮NSCLCの患者は、研究への参加に適格でした。 適格な患者は18歳以上であり、ECOGパフォーマンスステータススコアが0または1であり、バイオマーカー分析のために治療前の腫瘍組織標本を提出していました。”
<除外基準>Key exclusion criteria were autoimmune disease, symptomatic interstitial lung disease, systemic immunosuppression, prior therapy with T-cell costimulation or checkpoint-targeted agents, or prior docetaxel therapy. Patients who had received more than one prior systemic therapy for meta-static disease were excluded.
“重要な除外基準は、自己免疫疾患、症候性間質性肺疾患、全身性免疫抑制、以前の治療でした.T細胞共刺激またはチェックポイント標的薬剤、または以前のドセタキセル療法。 転移性疾患に対して複数回の全身療法を受けた患者は除外された。”
<研究デザイン>From October 2012 through December 2013, we enrolled 352 patients, of whom 272 underwent randomization; 135 patients were randomly assigned to receive nivolumab, at a dose of 3 mg per kilogram of body weight every 2 weeks, and 137 were randomly assigned to received docetaxel, at a dose of 75 mg per square meter of body-surface area every 3 weeks.
“2012年10月から2013年12月まで、352人の患者を登録し、そのうち272人が無作為化を受けました。 135人の患者が2週間ごとに体重1キログラムあたり3mgの用量でニボルマブを投与されるようにランダムに割り当てられ、137人が3週間ごとに体表面積1平方メートルあたり75mgの用量で投与されるドセタキセルにランダムに割り当てられました”
<研究の評価項目>The primary end point was overall survival. Patients were followed for survival continuously while they were receiving the study drugs and then every 3 months after discontinuation of treatment.
The rate of investigator-assessed confirmed objective response was modified to be the first secondary end point. Additional end points included progression-free survival, patient reported outcomes, efficacy according to tumor PD-L1 expression, and safety.
“主要エンドポイントは全生存期間でした。 患者は、治験薬を投与されている間、および治療の中止後3か月ごとに、生存のために継続的に追跡されました。”
“治験責任医師が評価した確認された客観的反応の割合は、最初の二次エンドポイントになるように修正されました。 追加のエンドポイントには、無増悪生存期間、患者から報告された転帰、腫瘍PD-L1発現による有効性、および安全性が含まれていました。”
<優越性試験⇔非劣勢試験>The boundary for declaring superiority for overall survival at the interim analysis was a P value of less than 0.03, which was based on an O’Brien–Fleming alpha-spending function. If the P value for overall survival indicated statistical significance, then the key secondary end points of response rate and progression-free survival were tested hierarchically at the 5% alpha level.
“中間分析で全生存期間の優位性を宣言するための境界は、0.03未満のP値でした。これは、オブライエン-フレミングのアルファ支出関数に基づいています。 全生存期間のP値が統計的有意性を示した場合、奏効率と無増悪生存期間の主要な二次エンドポイントを5%アルファレベルで階層的にテストしました。”
優越性試験…差があるかどうか確かめる試験。
非劣勢試験…一定の幅(マージン)を決めて、その範囲内に収まるかどうか確かめる試験。範囲内なら非劣勢。
特に、除外基準はAbstractに書いていないので注目することが多いです。
英語論文のResults(結果)
結果は色々な数値が書いてありますが、統計をかけていることが多いので、有意な差があるかどうかに注目します。
<結果①>Overall survival was significantly longer with nivolumab than with docetaxel (Fig. 1), with the risk of death 41% lower with nivolumab (hazard ratio, 0.59; 95% CI, 0.44 to 0.79;P<0.001).
“全生存期間は、ドセタキセルよりもニボルマブの方が有意に長く(図1)、ニボルマブの方が死亡リスクが41%低くなりました。”
<結果②>The rate of confirmed objective response was significantly higher with nivolumab than with docetaxel (20% [95% CI, 14 to 28] vs. 9% [95% CI, 5 to 15]; P = 0.008).
“確認された客観的反応の割合は、ドセタキセルよりもニボルマブの方が有意に高かった”
Resultsは数値が多いので、google翻訳してもうまくいかないことが多いです…。
FigureやTableにまとめられているはずなので、訳さずにFigureやTableを見ることも多いです。
※あくまで統計的に有意でも、臨床的に有意かどうかは読み手が判断しなければなりません。
英語論文のDiscussion(考察)
Discussionは、著者が思ったことが書かれています。
ほとんどの場合、最初の段落に結果の要約が書かれているので、Resultsを読むのが大変だったときはここをgoogle翻訳しましょう。
<結果の要約①>Here we report results of an international, prospective, randomized, phase 3 trial that showed superior survival and an improved safety profile with nivolumab versus standard-of-care docetaxel in patients with advanced, previously treated squamous-cell NSCLC.
“ここでは、進行した以前に治療を受けた扁平上皮NSCLC患者を対象に、ニボルマブと標準治療のドセタキセルを併用した場合の優れた生存率と安全性プロファイルの改善を示した、国際的な前向き無作為化第3相試験の結果を報告します。”
<結果の要約①>Consistent with the finding of superior overall survival, nivolumab was associated with a significant improvement across secondary efficacy end points.
“優れた全生存期間の発見と一致して、ニボルマブは二次有効性エンドポイント全体で有意な改善と関連していた。”
Limitation(研究の限界)も重要です。
今回の研究では明らかにできなかったことが書いてあります。これもほとんどの場合Abstractには書かれません。
<研究の限界>Limitations of these analyses were that PD-L1 expression was assessed in archival tumor tissue, which may not have reflected tumor PD-L1 status at the time of treatment, and that only 83% of the patients who underwent randomization had quantifiable PD-L1 expression.
“これらの分析の限界は、PD-L1発現がアーカイブ腫瘍組織で評価され、治療時の腫瘍PD-L1ステータスを反映していない可能性があり、ランダム化を受けた患者の83%のみが定量化可能なPD-L1発現を示したことでした。”
一番最後に、この論文の結論で締めくくられています。
<結論>In conclusion, nivolumab is a PD-1 checkpoint inhibitor that showed a clinically meaningful survival benefit, with an improved safety profile, over that seen with the current standard of care in patients with advanced, previously treated squamous-cell NSCLC.
“結論として、ニボルマブはPD-1チェックポイント阻害剤であり、進行した以前に治療を受けた扁平上皮NSCLC患者の現在の標準治療で見られるものよりも、安全性プロファイルが改善され、臨床的に意味のある延命効果を示しました。”
これらPICOに付け加えると、下記のようになります。
P(対象患者):
- 1つのプラチナ系化学療法レジメン治療後に再発した18歳以上、PS 0-1、治療前に組織標本を提出していた進行扁平上皮非小細胞肺がん(NSCLC)。
- 自己免疫性疾患、症候性間質性肺炎、全身免疫抑制、過去にT-cellや免疫チェックポイント阻害薬を使用、過去にドセタキセルを使用した患者は除外。
I(治療介入):2週間ごとに3mg/kgのニボルマブ(135人)
C(比較対象):3週間ごとに75mg/m2のドセタキセル(137人)
→非盲検ランダム化比較で優越性試験。
O(結果):全生存期間は有意に延長。客観的な反応(奏効率)、無増悪生存期間も有意にいい結果。PD-L1の発現による差は認められなかったが、治療前に提出していた組織標本によるものであり、治療時のPD-L1を反映していない可能性あり。
ここまでできると、だいぶ詳しく読めるようになりますね。
「型」「読む順番」「キーワード」をおさえてgoogle翻訳すると、あまり時間をかけずに内容を理解することができるようになります。
薬剤師が英語論文を読むタイミング
今回は、オプジーボが初めて肺癌に承認されたときの第三相臨床試験の論文をもとに解説しました。
しかし、実は私は第三相臨床試験の論文はあまり読みません…
理由は、承認の臨床試験の論文は製薬企業が日本語訳した資料を持っていたり、日本語でネット検索しても情報が得られるためです。
私が英語論文を読むタイミングは、「日本語では情報が得られないとき」です。
特に、
- 添付文書に載っていないような内容
- 海外での治療の位置づけ
- 製薬企業が関係なさそうな内容
上記は日本語での情報はほとんどないです。
また、Introductionで書かれている、「すでに分かっていること」を読んで、勉強したりします。
(今回は、もともとドセタキセルが標準治療だったんだということがわかりました)
今回は、もともとドセタキセルが標準治療だったんだということがわかりました
最近の例を挙げると、海外で経口抗がん剤治療での薬学的管理の有用性を発表した論文です。
タイトル:The Randomized AMBORA Trial: Impact of Pharmacological/Pharmaceutical Care on Medication Safety and Patient-Reported Outcomes During Treatment With New Oral Anticancer Agents.
(J Clin Oncol. 2021 Apr 6; JCO2003088.)
上記の方法を試して、実際にざっくりと読んでみましょう。
実際の英語論文で読み方を実践
まずは掲載ジャーナルを確認
Journal of Clinical Oncologyは米国臨床腫瘍学会(ASCO)が発行しているジャーナルで、IF = 32.956(2019年)であり、医学ジャーナル四天王に劣らない権威のあるジャーナルです。
がん領域ではトップクラスであり、掲載されるとガイドラインが変わるレベルですね。
Introductionの最後とDiscussionの最後
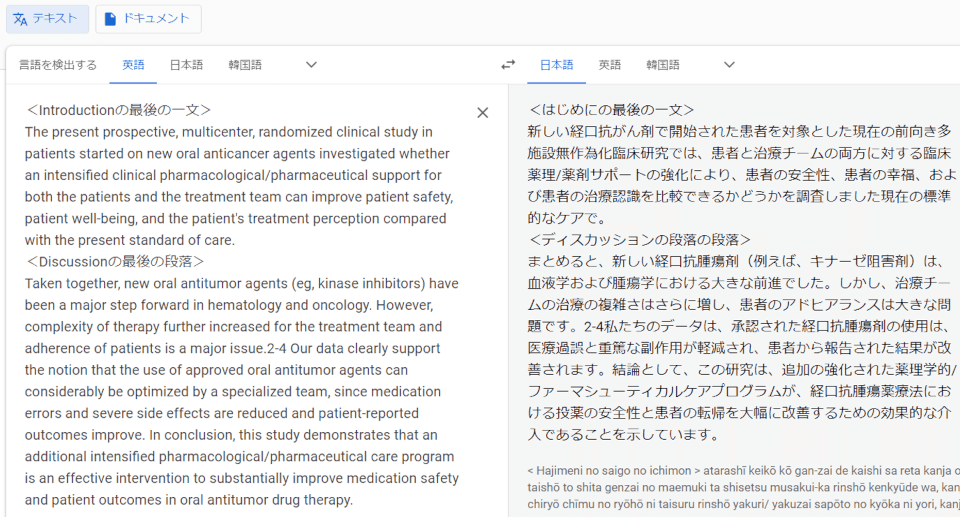
やはり、google翻訳はandのつなぎが弱いですね。
AbstractでPICOの把握
P:Patient(対象患者)
- 2001年以降に承認された経口抗がん剤のいずれかで新たに開始された患者
I:Intervention(治療介入)
- 強化された臨床薬理学/薬剤治療(投薬管理および構造化された患者カウンセリングを含む)のいずれかを12週間にわたって受ける患者
C:Comparison(比較対象)
- 標準治療
O:Outcome(結果)
- 抗腫瘍薬関連の問題は、対照群と比較して介入群で有意に低かった
- 重篤な副作用(有害事象の共通用語基準≥3)、治療中止、予定外の入院、および死亡の複合エンドポイントは低かった。
↓Abstractをgoogle翻訳した結果↓
経口抗がん剤(例、キナーゼ阻害剤)は、がん治療において重要な役割を果たします。しかし、経口抗がん剤の投薬の安全性に関するかなりの課題が報告されています。強化された臨床薬理学/ファーマシューティカルケアが患者の安全と患者の治療の認識に与える影響に関するランダム化比較多施設共同研究が不足しています。
患者は、特定の腫瘍実体に制限されることなく、2001年以降に承認された経口抗がん剤のいずれかで新たに開始された場合、ランダム化多施設AMBORA試験の対象となりました。患者は、標準治療(対照群)または追加の強化された臨床薬理学/薬剤治療(投薬管理および構造化された患者カウンセリングを含む)のいずれかを12週間にわたって受けるようにランダムに割り当てられました(介入群)。主要なエンドポイントは、抗腫瘍薬に関連する問題の数(すなわち、副作用と未解決の投薬ミス)と、12週間後の経口抗癌療法に対する患者の治療満足度を、カテゴリーの利便性に関する治療満足度アンケートで測定したものでした。
22人の患者が含まれていました。抗腫瘍薬関連の問題は、対照群と比較して介入群で有意に低かった(3.85 v 5.81 [平均]、P <.001)。患者の治療満足度は介入群で高かった(投薬のための治療満足度質問票、利便性; 91.6 v 74.4 [平均]、P <.001)。重篤な副作用(有害事象の共通用語基準≥3)、治療中止、予定外の入院、および死亡の複合エンドポイントのハザード比は0.48(95%CI、0.32〜0.71、P <.001)でした。介入グループの。
経口抗がん剤による治療は、広範囲の医療過誤と副作用に関連しています。強化された臨床薬理学/ファーマシューティカルケアは、医療過誤の数、患者の治療の認識、および重篤な副作用にかなりのプラスの影響を及ぼします。
キーワードを目印に本文を読む
<組み入れ規準>Eligible patients were $ 18 years and were scheduled by the treating physician for start of treatment with a new oral antitumor drug. New oral antitumor drug was defined as a drug, which was approved after capecitabine in 2001 in Germany focusing on emerging new mechanisms of actions starting with the kinase inhibitor imatinib.
“適格な患者は18歳以上であり、治療を行う医師によって新しい経口抗腫瘍薬による治療の開始が予定されていました。 新しい経口抗腫瘍薬は、2001年にドイツでカペシタビンの後に承認され、キナーゼ阻害剤であるイマチニブから始まる新しい作用機序に焦点を当てた薬剤として定義されました。”
<除外基準(少しわかりにくいですね…)>No tumor entities or stages were excluded.
“腫瘍の実体または病期は除外されませんでした。”
<研究デザイン①>The AMBORA trial (Medication Safety With Oral Antitumor Drugs) is an open-label, randomized, multicenter study.
“AMBORA試験(経口抗腫瘍薬による医薬品の安全性)は、非盲検、ランダム化、多施設共同試験です。”
<研究デザイン①>Patients were 1:1 randomly assigned to receive standard clinical care (control group) or an intensified clinical pharmacological/pharmaceutical care program added to standard of care (intervention group) over 12 weeks. Separate 1:1 random assignment lists were used for each oral antitumor agent (Data Supplement).
“患者は、標準治療(対照群)または標準治療に追加された強化された臨床薬理学/ファーマシューティカルケアプログラム(介入群)を受けるために1:1でランダムに割り当てられました。 個別の1:1ランダム割り当てリストが各経口抗腫瘍剤に使用されました(データ補足)。”
<研究の評価項目>Primary study end points were (1) the number of drug related problems (ie, side effects and unresolved medication errors) with reference to the oral anticancer medication within week 0 to week 12 and (2) patient treatment satisfaction with the oral anticancer therapy measured by the Treatment Satisfaction Questionnaire for Medication (TSQM Ver. II),16,17 category convenience, after 12 weeks.
“主要な研究のエンドポイントは、(1)0週から12週までの経口抗がん剤に関する薬物関連の問題(すなわち、副作用と未解決の投薬ミス)の数、および(2)経口抗がん療法に対する患者の治療満足度でした。 12週間後、治療満足度アンケート(TSQMVer。II)、16,17カテゴリーの利便性によって測定されました。”
Secondary endpointは長いので省略しました…。
<優越性試験⇔非劣勢試験>
(マージンを設けずに“差”があるかないかを検定しているので、優越性試験と同じようなデザインですね。)
<結果①>The number of drug-related problems (ie, side effects and unresolved medication errors) with reference to the oral anticancer medication was significantly lower in the intervention group compared with the control group.
“経口抗がん剤に関連する薬物関連の問題(すなわち、副作用および未解決の医療過誤)の数は、対照群と比較して介入群で有意に少なかった。”
<結果②>Patient treatment satisfaction with the oral anticancer therapy after 12 weeks was significantly higher in the intervention group than in the control group.
“12週間後の経口抗癌療法に対する患者の治療満足度は、対照群よりも介入群で有意に高かった。”
<結果の要約>This is the first randomized, multicenter trial reporting a substantial improvement of medication safety and outcomes during oral antitumor therapy by applying an additional intensified clinical pharmacological/pharmaceutical care program to standard of care. Clinically relevant effects were observed for both side effects and medication errors and for patient-reported outcomes in favor of the intervention group.
“これは、追加の強化された臨床薬理学/ファーマシューティカルケアプログラムを標準治療に適用することにより、経口抗腫瘍療法中の投薬の安全性と結果の大幅な改善を報告する最初のランダム化多施設共同試験です。 臨床的に関連する効果は、副作用と投薬ミスの両方、および介入群を支持する患者報告の結果について観察されました。”
<研究の限界>The following limitations of this study need to be considered. Blinding of patients and physicians was not possible because of practical reasons.
“この研究の以下の制限を考慮する必要があります。患者と医師の盲検化は、実際的な理由のために不可能でした。”
このほか、
”対照群では治療中止がかなり多かったため、介入群では対照群に比べて患者あたりの平均観察時間が長かったため、すべてのパラメーターの効果量は過小評価されている可能性がある。”
”個々の経口抗腫瘍剤のグループサイズは小さすぎて、介入が特に効果的であった抗腫瘍剤と、介入があまり効果的でない可能性がある抗腫瘍剤を区別することができなかった。”
も挙げられています。
これまでの情報でのPICO
P:Patient(対象患者)
- 2001年以降に承認された経口抗がん剤のいずれかで新たに開始された患者
- 多施設共同研究。腫瘍の実体または病期では除外されなかった。
I:Intervention(治療介入)
- 強化された臨床薬理学/薬剤治療(投薬管理および構造化された患者カウンセリングを含む)のいずれかを12週間にわたって受ける患者
C:Comparison(比較対象)
- 標準治療
→多施設で前向き非盲検化ランダム化試験。
O:Outcome(結果)
- 抗腫瘍薬関連の問題(有害事象、医療過誤など)は、対照群と比較して介入群で有意に低かった。患者満足度は有意に高かった。
- 重篤な副作用(有害事象の共通用語基準≥3)、治療中止、予定外の入院、および死亡の複合エンドポイントは低かった。
→経口抗がん剤治療を受ける患者において薬学的管理の強化が有害事象や患者満足度向上に寄与するか検討した初めてのランダム化比較試験。
ざっくり内容が把握できますね。
「薬学的管理が経口抗がん剤の服用を減らしたり患者満足度を上げるというエビデンスが米国臨床腫瘍学会のジャーナルで出たよ」と言えますね
今までは何が分かっていたのか、詳しいエンドポイントなどが気になる方は本文を頑張って読みましょう。
今まで何がわかっていて、何が問題とされていたのかが分かります。
まとめ:英語論文は型・順番・キーワードをおさえてgoogle翻訳フル活用でざっくり読める
Google翻訳を使えば、英語が読めなくても英語論文のある程度の内容は理解できます。最初から全部読もうとせず、できるだけ情報になれる必要があります。
ほとんどの薬剤師が”英語”に対して抵抗があると思います。
この方法を実践できた薬剤師は、他の薬剤師が持っていない情報を得ることができます。
少し慣れは必要かもしれませんが、苦手意識さえなくなればスキルアップになること間違いないでしょう。
このサイトでは、病院薬剤師が年収をあと150万円上げる3つの力について解説しています!
3つの力のうち、本当に知っておいてほしい「スキルアップ」の力について現役病院薬剤師やくごろうがまとめています。