こんな方へ
- 新薬がどんどん出てきて、毎回把握しきれない!
- 新薬のどの情報が重要かわからない!
- 今後その新薬を扱うかわからないし、まず要点だけ知りたい!
毎日激務の薬剤師は、新薬の情報をタイムリーに把握することはほとんど無理ですよね。私は病院薬剤師として大規模総合病院で勤務していますが、今後扱うのかもわからない全ての新薬を調べる時間がないので、ざっくり特徴だけ把握することにしました。
そこで、この記事では新薬の特徴と要点をざっくり簡単に現役病院薬剤師やくごろうが解説します。
この記事を読めば、これから世の中に出てくる新薬を時間をかけずに勉強でき、いざ必要になったときに調べることがとても楽になります。
毎日激務で、新薬について簡単に把握したい薬剤師の方におすすめです!
2021年5月24日、厚生労働省 薬事・食品衛生審議会再生医療等製品・生物由来技術部会が開催され、新薬の承認可否が審議されました。
※ざっくりまとめ用ですので、正式な名称や用法用量は参考資料などから確認お願いします。
※正式承認は未ですので、ご注意ください。
デリタクト注
悪性神経膠腫に使用する世界初のがん治療用人工ウイルス
成分名:テセルパツレブ
メーカー:第一三共
申請適応:悪性神経膠腫
がん細胞でのみ増殖可能となるよう設計された人為的三重変異を有する増殖型遺伝子組換え単純ヘルペスウイルス1型(第三世代がん治療用単純ヘルペスウイルス1型)G47Δ。
がん細胞に感染させることでウイルスが増殖し対象の細胞を死滅させる、世界初のがん治療用人工ウイルス。
先駆け審査指定制度指定品目。
放射線療法およびテモゾロミド化学療法施行後に、組織学的に残存または再発の膠芽腫が確認された患者が対象となり、定位脳手術により腫瘍部位に局所投与する。
投与1回目と2回目は7日(5~14日)の間隔をおいて投与し、3回目以降は前回の投与から4週間(±2週間)の間隔をおいて投与を最大で6回。 条件および期限付きで承認了承となり、7年後に再度承認申請する条件がついている。
オキュラル
角膜上皮幹細胞疲弊症に使用する自家培養口腔粘膜上皮由来細胞シート
成分名:ヒト(自己)口腔粘膜由来上皮細胞シート
メーカー:ジャパン・ティッシュ・エンジニアリング(J-TEC)
申請適応:角膜上皮幹細胞疲弊症
患者の口腔粘膜組織から採取した細胞を培養して作製する自家培養口腔粘膜上皮由来細胞シート。
シートとして移植した口腔粘膜上皮細胞が生着・上皮化することにより、欠損した角膜上皮を再建・修復させることを目的としている。
角膜上皮幹細胞疲弊症のステージ3(角膜表面全体が結膜組織で被覆されている状態)に対する治療法。
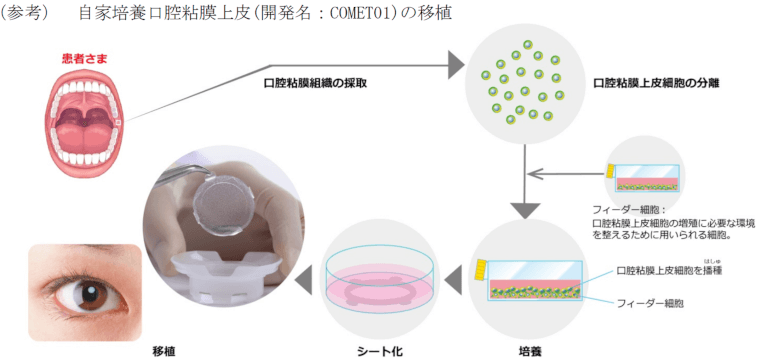
株式会社ジャパン・ティッシュ・エンジニアリング(J-TEC)自家培養口腔粘膜上皮(開発名:COMET01):部会了承に関するお知らせ
やくごろうPick Up:原発性脳腫瘍の薬物療法
原発性脳腫瘍に対する薬物療法は、投与した薬物がBBB(血液脳関門)を通過する必要があるため、使用できる治療薬が非常に限られています。
星細胞系や乏突起膠腫系、悪性度によって治療法やエビデンスは異なりますが、ここでは日本癌治療学会ガイドラインの存在する成人膠芽腫にスポットを当ててざっくりおさらいします。
※あくまでざっくりまとめ用なので、正確な情報は各添付文書やガイドラインをご参照下さい。
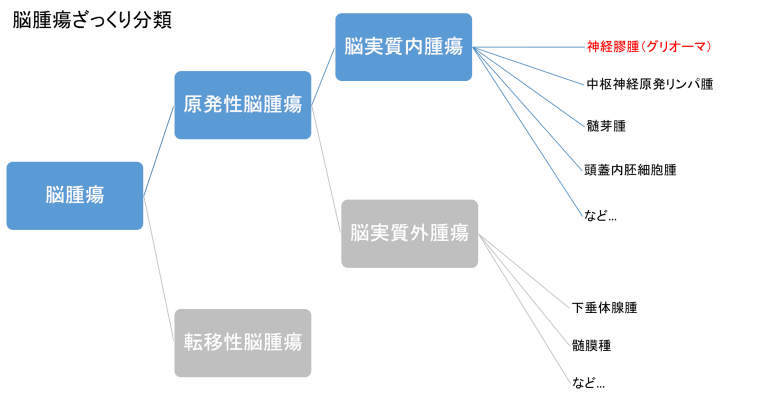
脳腫瘍の分類
一口に”脳腫瘍”と言っても様々な分類があります。まずは分類からおさらいします。

初発治療:Stuppプロトコール
手術
→放射線療法+テモゾロミド(±ベバシズマブ)併用療法 6週間
→テモゾロミド(±ベバシズマブ)維持療法 28日×6コース
(→ベバシズマブ維持療法継続 21日×病勢進行まで)
※Stuppプロトコールへのベバシズマブの上乗せについて
最近発表された2つの第III相試験(AVAGlio試験,RTOG0825試験)において,全生存期間に関するベバシズマブのStuppプロトコールへの上乗せ効果は認められていません。
無増悪生存期間,QOL 保持・改善の観点からはベバシズマブの上乗せ効果の評価はこの二つの試験が相反する結果となっています。
このため、初発膠芽腫の初期治療には標準治療ではなく、あくまでオプションの位置づけのようです。
再発治療
再手術を検討
- 腫瘍塊による症状軽減
- ステロイド投与量の減量
- 追加療法の効果を高める
→定位放射線照射を検討(局所病変の制御を目的)
→化学療法
- テモゾロミド(テモゾロミド未使用例)
- ベバシズマブ単剤(再発の星細胞腫と退形成性星細胞腫にも無効のエビデンスあり、海外では再発例は膠芽腫のみ適応)
※ベバシズマブ公知申請の申請資料では、「グレード3の神経膠腫が再発した場合には、病理学的に悪性転化を示し膠芽腫に進展することが多いため、ベバシズマブの適応拡大を再発膠芽腫だけでなく、再発悪性神経膠腫とした」と記載されています。
手術時に使用するギリアデル
ギリアデル(カルムスチン脳内留置用徐放性ポリマー)
開頭手術でグリオーマを摘出し、その穴(摘出腔)に貼付ける薬剤です。
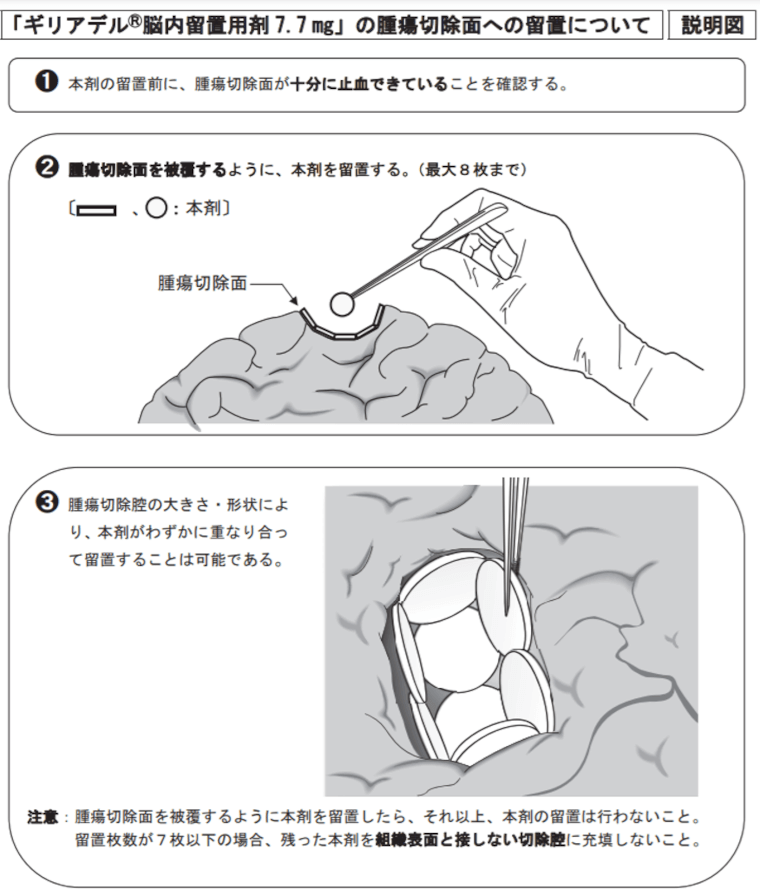
初発手術例では、術中迅速病理でGrade3~4の神経膠腫が疑われた場合+手術でほぼ取り切れるときに使用されます。
英国NICEガイダンスでは、「腫瘍切除術で腫瘍を90%以上切除された患者に対して、新規に診断された高悪性度の神経膠腫の1つの治療法として推奨される。」と記載されています。
- 初発手術例生存期間中央値:
- カルムスチン徐放性ポリマー群(13.9カ月)v.s.プラセボ群(11.6カ月)
- 再発手術例生存期間中央値:
- カルムスチン徐放性ポリマー群(31週)v.s.プラセボ群(23週)
※単変量解析では有意差ないが、post-hoc多変量解析では有意差あり。
- カルムスチン徐放性ポリマー群(31週)v.s.プラセボ群(23週)
約16万円/枚×最大8枚=128万円と高額であり、−15℃以下での保存が求められる薬剤です。
新薬デリタクト注の位置づけ
デリタクト注はGrade3,4の悪性神経膠腫に対する治療法として、放射線治療+テモゾロミドの治療歴を有し、治療後にも腫瘍が残存または治療後に再発した病変数が1つの膠芽腫患者に対する治療法です。
東京大学研究グループが第Ⅱ相医師主導臨床試験を行いました。
臨床試験の結果はまだ論文として公表されていませんが、中間解析の結果では
放射線+テモゾロミド+デリタクト
v.s. 放射線+テモゾロミド+プラセボ
1年生存割合:92.3% vs 15%
と高い治療効果が確認されています。
東京大学医科学研究所脳腫瘍外科プレスリリース
厚生労働省より悪性神経膠腫を対象として2016年2月に先駆け審査指定を受けるとともに、2017年7月に希少疾病用再生医療等製品の指定を受けています。
「先駆け審査指定制度」とは、革新的な医薬品などを世界に先駆けて日本で早期実用化を目指すために、一定の要件を満たす画期的な新薬等が指定される制度です。
先駆け審査指定制度はこちらの記事で解説しています。
定位脳手術により腫瘍部位に局所投与を複数回行うので、侵襲度は高いかもしれませんね。
悪性中皮腫などにも臨床試験を行っているようです。
過去の新薬まとめ記事や、病院薬剤師が年収を上げるための「スキルアップ」の力はこちら
過去の新薬まとめ記事はこちらでまとめています。
このサイトでは、病院薬剤師が年収をあと150万円上げる3つの力について解説しています!
3つの力のうち、本当に知っておいてほしい「スキルアップ」の力について現役病院薬剤師やくごろうがまとめています。
主な参考情報
厚生労働省;薬事・食品衛生審議会
https://www.mhlw.go.jp/stf/shingi/indexshingi.html
ミクスオンライン(簡単に無料で見れるニュース)
https://www.mixonline.jp/
日刊薬事(薬事・食品衛生審議会の議題は無料)
https://nk.jiho.jp/
日本癌治療学会脳腫瘍診療ガイドライン2016
http://www.jsco-cpg.jp/brain-tumor/guideline/
東京大学医科学研究所
がん治療用ヘルペスウイルスG47Δの実用化へ最終段階
https://www.ims.u-tokyo.ac.jp/imsut/jp/about/press/page_00062.html